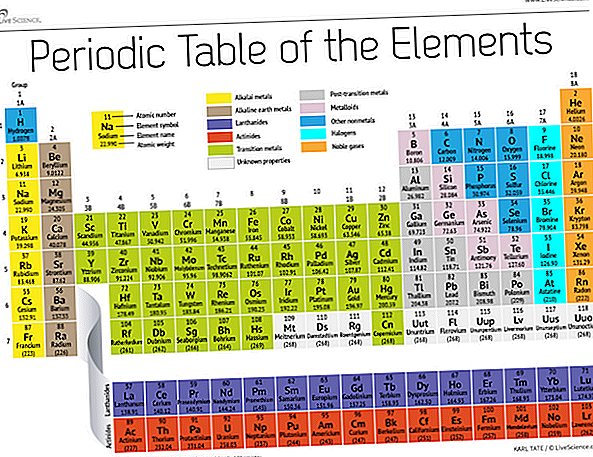
Pod koniec XIX wieku rosyjski chemik Dmitrij Mendelejew opublikował swoją pierwszą próbę grupowania pierwiastków chemicznych według ich mas atomowych. W tym czasie znanych było tylko około 60 pierwiastków, ale Mendelejew zdał sobie sprawę, że kiedy pierwiastki były zorganizowane wagowo, pewne rodzaje pierwiastków występowały w regularnych odstępach czasu lub okresach.
Dziś, 150 lat później, chemicy oficjalnie rozpoznają 118 pierwiastków (po dodaniu czterech nowych osób w 2016 r.) I nadal używają okresowego układu pierwiastków Mendelejewa do ich organizowania. Tabela zaczyna się od najprostszego atomu, wodoru, a następnie porządkuje resztę pierwiastków według liczby atomowej, czyli liczby protonów zawartych w każdym z nich. Z kilkoma wyjątkami kolejność pierwiastków odpowiada rosnącej masie każdego atomu.
Tabela ma siedem wierszy i 18 kolumn. Każdy wiersz reprezentuje jeden okres; numer okresu elementu wskazuje, ile jego poziomów energii elektronów domowych. Na przykład sód znajduje się w trzecim okresie, co oznacza, że atom sodu zazwyczaj ma elektrony w pierwszych trzech poziomach energii. Przechodząc w dół tabeli, okresy są dłuższe, ponieważ potrzeba więcej elektronów, aby wypełnić większe i bardziej złożone poziomy zewnętrzne.
Kolumny tabeli reprezentują grupy lub rodziny elementów. Elementy w grupie często wyglądają i zachowują się podobnie, ponieważ mają tę samą liczbę elektronów w swojej najbardziej zewnętrznej powłoce - twarz, którą pokazują światu. Na przykład elementy z grupy 18 po skrajnej prawej stronie stołu mają całkowicie pełne skorupy zewnętrzne i rzadko uczestniczą w reakcjach chemicznych.
Elementy są zazwyczaj klasyfikowane jako metalowe lub niemetalowe, ale linia podziału między nimi jest rozmyta. Elementy metalowe są zwykle dobrymi przewodnikami prądu i ciepła. Podgrupy w obrębie metali opierają się na podobnych właściwościach i właściwościach chemicznych tych kolekcji. Nasz opis układu okresowego wykorzystuje powszechnie akceptowane grupy elementów, zgodnie z Los Alamos National Laboratory.
Metale alkaliczne: Metale alkaliczne stanowią większość grupy 1, pierwszej kolumny tabeli. Błyszczące i wystarczająco miękkie, aby ciąć nożem, metale te zaczynają się od litu (Li), a kończą na francie (Fr). Są również wyjątkowo reaktywne i wybuchną płomieniem, a nawet wybuchną w kontakcie z wodą, dlatego chemicy przechowują je w olejach lub gazach obojętnych. Wodór z pojedynczym elektronem również występuje w grupie 1, ale gaz jest uważany za niemetaliczny.
Metale ziem alkalicznych: Metale ziem alkalicznych tworzą grupę 2 układu okresowego, od berylu (Be) do radu (Ra). Każdy z tych pierwiastków ma dwa elektrony na swoim najbardziej zewnętrznym poziomie energetycznym, co powoduje, że ziemie alkaliczne są wystarczająco reaktywne, tak że rzadko występują same w naturze. Ale nie są tak reaktywne jak metale alkaliczne. Ich reakcje chemiczne zwykle zachodzą wolniej i wytwarzają mniej ciepła w porównaniu z metalami alkalicznymi.
Lantanowce: Trzecia grupa jest o wiele za długa, aby zmieścić się w trzeciej kolumnie, więc jest rozbita i odwrócona na boki, aby stać się najwyższym rzędem wyspy unoszącym się na dole stołu. Są to lantanowce, pierwiastki od 57 do 71 - lantan (La) do lutetu (Lu). Elementy z tej grupy mają srebrzystobiały kolor i matowieją w kontakcie z powietrzem.
Aktynowce: Aktynowce pokrywają dolny rząd wyspy i zawierają pierwiastki 89, aktyn (Ac), do 103, lawren wapń (Lr). Spośród tych pierwiastków tylko tor (Th) i uran (U) występują naturalnie na Ziemi w znacznych ilościach. Wszystkie są radioaktywne. Aktynowce i lantanowce razem tworzą grupę zwaną wewnętrznymi metalami przejściowymi.
Metale przejściowe: Wracając do głównej treści tabeli, pozostałe grupy od 3 do 12 reprezentują resztę metali przejściowych. Twarde, ale ciągliwe, lśniące i posiadające dobrą przewodność, te elementy są tym, o czym zwykle myślisz, gdy słyszysz słowo metal. Tutaj mieszka wiele największych hitów świata metalu - w tym złoto, srebro, żelazo i platyna.
Metale przejściowe: Przed skokiem do świata niemetalicznego wspólne cechy nie są starannie podzielone wzdłuż pionowych linii grup. Metale po przejściu to glin (Al), gal (Ga), ind (In), tal (Tl), cyna (Sn), ołów (Pb) i bizmut (Bi), i obejmują one grupę od 13 do grupy 17. Te pierwiastki mają niektóre z klasycznych właściwości metali przejściowych, ale wydają się być bardziej miękkie i przewodzą gorzej niż inne metale przejściowe. Wiele okresowych tabel będzie zawierało pogrubioną linię „schodów” poniżej przekątnej łączącej bor z astatyną. Metale po przejściu skupiają się w lewym dolnym rogu tej linii.
Metaloidy: Metaloidy to bor (B), krzem (Si), german (Ge), arsen (As), antymon (Sb), tellur (Te) i polon (Po). Tworzą schody, które reprezentują stopniowe przejście od metali do niemetali. Elementy te czasami zachowują się raczej jak półprzewodniki (B, Si, Ge) niż jako przewodniki. Metaloidy są również nazywane „półmetalami” lub „złymi metalami”.
Niemetale: Wszystko inne w prawym górnym rogu klatki schodowej - plus wodór (H), splatany z powrotem w grupie 1 - jest niemetaliczny. Należą do nich węgiel (C), azot (N), fosfor (P), tlen (O), siarka (S) i selen (Se).
Halogeny: Cztery górne elementy grupy 17, od fluoru (F) do astatyny (At), reprezentują jeden z dwóch podzbiorów niemetali. Halogeny są dość reaktywne chemicznie i mają tendencję do łączenia się z metalami alkalicznymi w celu wytworzenia różnych rodzajów soli. Na przykład sól kuchenna w kuchni stanowi połączenie sodu sodu z metalem alkalicznym i chlorowca chlorowca.
Gazy szlachetne: Bezbarwne, bezwonne i prawie całkowicie niereaktywne gazy obojętne lub szlachetne dopełniają stół w grupie 18. Wielu chemików oczekuje, że oganesson, jeden z czterech nowo nazwanych pierwiastków, podzieli te cechy; Ponieważ jednak ten element ma okres półtrwania w milisekundach, nikt nie był w stanie go bezpośrednio przetestować. Oganesson kończy siódmy okres układu okresowego, więc jeśli komuś uda się zsyntetyzować element 119 (a wyścig do tego już się rozpoczął), zapętli się, aby rozpocząć ósmy rząd kolumny z metalami alkalicznymi.
Ze względu na cykliczną naturę wynikającą z okresowości, która nadaje tabeli nazwę, niektórzy chemicy wolą wizualizować stół Mendelejewa jako okrąg.
Dodatkowy zasoby: